Lipid rafts: contentious only from
simplistic standpoint
Las balsas lipídicas existen en las membranas plasmáticas y tiene fundamental funciones biológicas. La heterogeneidad de las proteínas en el lateral la membrana plasmática es indiscutible, pero la contribución de colesterol depende de asambleas de los lípidos a este complejo, no aleatoria organización promueve el vigoroso debate. Los nuevos estudios propusieron un modelo actualizado de las balsas lipídicas que
se ajusta fácilmente a diversos puntos de vista sobre la membrana plasmática de micro-empresa.
Un análisis de la obra reciente con membranas modelo y membranas intactas plasma, con técnicas experimentales que exploran corto duración y los plazos, junto con modelos computacionales, indican que la estructura y función de balsa de lípidos dominios en la membrana plasmática se justifica. Este modelo revisado de las necesidades de tener en cuenta un papel más importante para la membrana plasmática de las proteínas en la captura.
Se dan dos puntos de vista polarizados cerca de este tema: la idea de pre-existentes de las balsas de la organización dominante principio en la membrana plasmática, en comparación con la idea de que las balsas no existen y por lo tanto, no tienen ningún papel en función de la membrana plasmática.
Por ello se puede decir que las balsas si pueden existir, pero su longitud y especificaciones de escala de tiempo, son características de vital importancia que deben ser incluidos en cualquier definición.
Para probar la hipótesis, se deben aplicar técnicas de imagen que puede
explorar las distancias cortas y los plazos en membranas intactas que se necesita para construir un mundo más amplio espacio-temporal del mapa de las proteínas en la membrana plasmática.
THE FLUID MOSAIC MODEL OF THE STRUCTURE OF CELL MEMBRANES
Las membranas biológicas juegan un papel crucial en casi todos los fenómenos celulares, aun nuestro entendimiento de la organización de las membranas es rudimentaria. Nosotros sugerimos que existe una analogía entre los problemas de la estructura de la membrana y de las proteínas.
Singer ha examinado recientemente en muchos modelos detallados considerables de la organización estructural grosa de las membranas, en términos de la termodinámica de los sistemas macromoleculares y en la luz de la entonces evidencia experimental disponible. De este análisis, fue concluido que la estructura de mosaico de las proteínas globulares alternantes y bicapa de fosfolípidos fue el único modelo de membrana entre aquellos analizados que fue simultáneamente consistente con las restricciones termodinámicas en que todos los datos experimentales. Desde que el artículo fue escrito, mucha nueva evidencia ha sido publicada y apoya fuertemente el modelo de mosaico. En particular el mosaico parece ser fluida y dinámica para muchos propósitos. En este artículo por tanto presentamos y discutimos un modelo de mosaico fluido de estructura de membrana y proponemos que es aplicable a la mayoría de membranas biológicas tales como plásmalema y membranas de diferentes organelos celulares tales como mitocondria y cloroplastos.
El modelo de mosaico fluido ha evolucionado por una serié de estadios de versiones previas o anteriores. Las consideraciones termodinámicas acerca de las membranas y componentes de membranas iniciados, son aun centrales a estos desarrollos a esos estadios.
Hay otras interacciones no covalentes, tal como la unión a hidrogeno en interacciones electrostáticas, que también contribuyen a diferentes estructuras macromoléculas, sin embargo con respecto a la estructura grosa hay muchas probabilidades de magnitud secundaria comparado con interacciones hidrófobicas e hidrofilicas
La bicapa fosfolípida ilustro los efectos combinados de interacciones hidrofobicas e hidrofilicas en esta estructura las cadenas de ácidos grasos no polares de los fosfolípidos son secuestrados juntos lejos del contacto con agua por tanto maximiza la interacciones hidrofobicas más aun los grupos iónicos y bipolares están en contacto directo con la fase acuosa en la superficie exterior de la bicapa , por tanto hidrofilicas . En el caso de fosfolípidos bipolares tales como fosfatidil colina, las interacciones bipolares entre los pares de iones en la superficie de la bicapa pueden contribuir también a la estabilidad de la estructura de la bicapa.
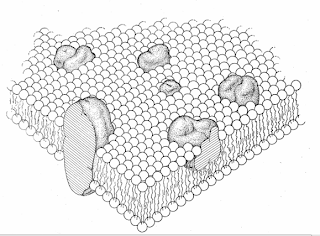
Fig. 2. la
lípido-globular proteína modelo del mosaico de la estructura de la membrana: Esquema
la sección transversal. Los fosfolípidos organizan como una doble capa discontinua con sus cabezas iónicas y polares en contacto con el agua. algunos lípidos pueden estar estructuralmente diferenciado de la mayor parte de los lípidos. Las proteínas integrales, con las líneas gruesas repre- senting las cadenas de polipéptidos plegados, se muestran como moléculas globulares parcialmente em-cama adentro, y en parte que sobresale de la membrana. Las partes salientes han en su superficie los residuos iónicos (- y +) de la proteína, mientras que los no polares
Fig. 3. El lípido-proteína globular modelo de mosaico con una matriz de lípidos (el mosaico fluido modelo), vistas esquemáticas de tres dimensiones y transversal. Los cuerpos sólidos con superficies punteadas representan las proteínas globulares integral, que a larga distancia se distribuidos al azar en el plano de la membrana. | |||