Todo lo que podemos ver y tocar es materia. También son materia cosas que no podemos ver, como el aire.
Observamos que la materia ocupa una cierta porción de espacio que llamamos volumen. En el caso del aire esto no es evidente, pero si es materia. |
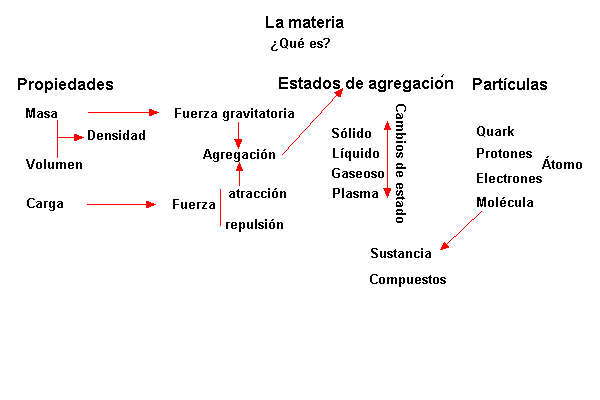
Podemos decir que es materia todo lo que ocupa volumen y tiene masa. La materia forma todos los cuerpos del universo. Propiedades
Volumen
Todos los objetos tienen tres dimensiones: largo, ancho y alto, y ocupan un lugar en el espacio (volumen).
Podemos medir la longitud entre las distintas partes del propio cuerpo y las distancias entre los diferentes cuerpos
De los objetos que no tienen ninguna de sus dimensiones mucho menor que l as otras, como una pelota o un televisor, nos interesa su volumen, que es el producto de la longitud por la anchura y por la profundidad (y por un número que depende de la forma geométrica del cuerpo).
Medimos los volúmenes, por tanto, con la unidad (metro x metro x metro) o metro cúbico (o decámetro cúbico, decímetro cúbico, etc.).
El volumen de un sólido o de un líquido se debe al volumen de sus partículas y a su disposición en el espacio -cómo se acomodan unas junto a las otras-.El volumen de un gas se debe, en cambio, a la separación entre sus partículas, muy grande comparada con su tamaño, que apenas influye.
v Masa
La masa, propiedad esencial de la materia, se mide con la balanza. Cuanta más materia tenga un cuerpo, más masa tendrá y más pesará. La masa se expresa en kilogramos (kg).Por ejemplo, una manzana tiene una masa de 0,15 kg. |
Pero también podemos usar cualquier otra unidad de masa, como el gramo (g), la tonelada (t), el gigagramo (Gg), etc.
La masa de un cuerpo sólo depende de las masas de sus partículas : es la suma de la masa de todas ellas.
v Densidad
La Densidad es una propiedad física de la materia que se define como la proporción de la masa de un objeto a su volumen.
Arquímedes es acreditado por ser una de las primeras personas en considerar la densidad como una propiedad de la materia.
La flotabilidad de un objeto es determinado por su densidad en relación la densidad del líquido que lo rodea.
Evidentemente todos los materiales que nos rodean son distintos unos a otros. Tienen
distintas características o propiedades. Los hay más duros, más blandos; más grandes,
más pequeños, de distintos colores, olores, etc… Estas propiedades nos permiten
identificar la materia.
Por lo cual podemos distuingir otras propiedades que pueden ser cualitativas y cuantitativas:
• Cualitativas: no se pueden medir y no se pueden expresar por medio de
cantidades. Como por ejemplo el tacto, el color, el olor, etc…
• Cuantitativas: Se pueden medir y se pueden expresar por medio de cantidades.
Como por ejemplo el peso, la longitud, etc…
Organización de la materia
La materia casi siempre está agrupada formando cuerpos, y a eso contribuyen la fuerza gravitatoria que surge entre las masas, y la fuerza electrostática, que se origina entre las cargas eléctricas. Estas dos fuerzas regulan la forma de agruparse la materia, aunque la gravitación sólo produce efectos apreciables en los cuerpos de gran masa (planetas, estrellas, etc.).
Efectos de la gravedad:
La fuerza de atracción gravitatoria es la responsable no sólo de la caída de los cuerpos, sino también de la trayectoria de cualquier astro alrededor de otro. Y también, por supuesto, delmovimiento de los satélites artificiales y de la Luna alrededor de la Tierra. Dependiendo de lo rápido que se mueva el satélite paralelamente al suelo, la trayectoria resultante puede ser muy diferente.
Carga eléctrica
La materia tiene también otra propiedad llamada carga eléctrica, que puede ser de dos tipos:positiva y negativa.
a) Los cuerpos con cargas de distinto signo se atraen.
b) Los cuerpos que tienen cargas del mismo signo se repelen
La fuerza eléctrica, tanto atractiva como repulsiva, es muchísimo más intensa que la gravitatoria. |
Sin embargo, la carga no se manifiesta casi nunca en los objetos ordinarios, sino que permanece oculta en las particulas que constituyen sus átomos.
Estas partículas son: protones y neutrones en el núcleo atómico, y electrones girando a su alrededor. Los neutrones no tienen carga (son neutros); los protones tienen carga positiva, y los electrones, negativa del mismo valor. Como en un átomo hay igual número de protones que de electrones, la carga neta del átomo, y de toda la materia en general, es nula.
Estados de agregación
v Solido
En el estado sólido los cuerpos tienen un volumen casi invariable (incompresibilidad) debido a que sus partículas (átomos, iones o moléculas) están prácticamente en contacto, por lo cual no se pueden aproximar más.
La forma de los sólidos es también invariable, porque sus partículas están perfectamente ordenadas ocupando posiciones fijas en estructuras tridimensionales repetitivas llamadas cristales. Las partículas no están quietas en sus posiciones sino que vibran sin cesar, tanto más intensamente cuanto mayor es la temperatura. Si ésta llega a ser lo suficientemente alta (temperatura de fusión) las partículas pierden sus posiciones fijas y, aunque siguen muy juntas, desaparece la estructura cristalina, exclusiva de los sólidos, para transformarse en líquidos.
Las sustancias cristalinas que son solubles en agua vuelven a cristalizar cuando ésta se evapora.
v Liquido
La forma de los líquidos es variable (adoptan la forma que tiene el recipiente) porque, por encima de la temperatura de fusión, las partículas no pueden mantener las posiciones fijas que tienen en estado sólido y se mueven desordenadamente.
Sin el efecto de la gravedad, la forma natural de los líquidos es la esférica (la gota). El volumen de los líquidos es prácticamente invariable, porque las partículas, aunque no forman una estructura fija como en el caso de los sólidos, se mantienen, como en ellos, relativamente juntas.
Los líquidos pueden fluir, ya que sus partículas, al tener libertad y no ocupar posiciones fijas, pueden desplazarse por los huecos que aparecen entre ellas, permitiendo el movimiento de toda la masa líquida.
v Gaseoso
Los movimientos de las partículas de un líquido se hacen más amplios y rápidos al calentarlo y aumentar su temperatura. Por encima de la temperatura de ebullición, las partículas pierden el contacto entre sí y se mueven libremente en todas direcciones (estado gaseoso).
Los gases se difunden hasta ocupar todo el recipiente que los contiene porque, a diferencia de los sólidos y líquidos, tienen sus partículas muy separadas moviéndose caóticamente en todas direcciones. El movimiento de cada partícula no se verá perturbado mientras no choque con otra partícula o con las paredes del recipiente. Por esta razón, los gases acaban ocupando todo el volumen del recipiente.
La forma de los gases es variable, adoptan la de cualquier recipiente que los contenga.
El volumen de los gases es facilmente modificable porque se los puede comprimir y expandir.
Presionando un gas se disminuye la separación entre sus partículas, cosa que no puede ocurrir en los estados sólido y líquido.
Los átomos normalmente están en estado neutro: la carga positiva del núcleo es igual a la carga negativa de los electrones.
La agitación de un gas aumenta cuando absorbe calor. Si el calor absorbido es suficiente, los electrones de los átomos son arrancados y la materia queda ionizada, diciéndose que está en estado de plasma.
Es plasma todo gas incandescente formado por átomos (a veces moléculas) convertidos en iones positivos y electrones negativos, y todo en continua agitación. Dentro de ese gas pueden quedar también algunos átomos y moléculas sin ionizar (partículas neutras).
Ejemplos de gases en estado de plasma son:
Algunas zonas de las llamas, el gas de los tubos fluorescentes, el aire que se encuentra en el recorrido de un rayo. |
Cambios de estado de agregación