Se define ósmosis como una difusión pasiva, caracterizada por el paso del agua, disolvente, a través de la membrana semipermeable, desde la solución más diluida a la más concentrada.
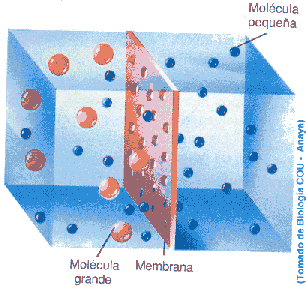
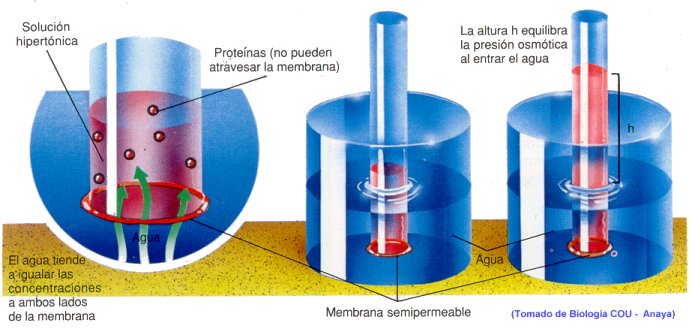
Es la presión que existe entre dos recipientes separados por una membrana semipermeable, si en uno de ellos existe una disolución y en el otro un disolvente puro. El osmol es la unidad de medida, y equivale a la de un mol disuelto en un litro de agua, a una presión de 22.4 atm y a 0º grados de temperatura.

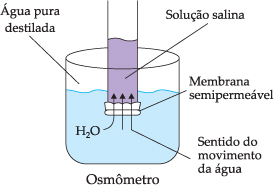
La parte de la física que trata de la medida de la presión osmótica recibe el nombre osmometría.
El osmómetro es el aparato utilizado para medir la presión osmótica y, con ello, la masa molecular de una disolución.
Por tanto la presión que un gas ejerce a una temperatura dada, si un número determinado de sus moléculas ocupa un volumen definido, es igual a la presión osmótica que produce la mayor parte de las sustancias bajo las mismas condiciones, si están disueltas en un líquido dado.
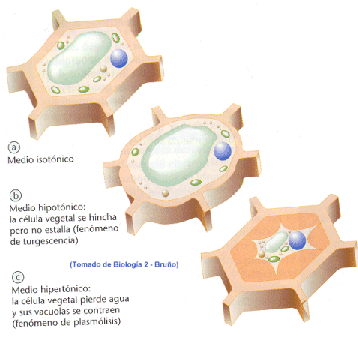
Si los líquidos extracelulares aumentan su concentración de solutos, se haría hipertónica respecto a las células, como consecuencia se originan pérdida de agua y deshidratación (plasmólisis)
De igual forma, si los líquidos extracelulares se diluyen, se hacen hipotónicos respecto a las células. El agua tiende a pasar al protoplasma y las células se hinchan y se vuelven turgentes, pudiendo estallar (en el caso de células vegetales la pared de celulosa lo impediría), por un proceso de turgescencia.
Ecuación de presión osmótica (π)
La presión osmótica (propiedad coligativa) depende de la concentración en mol/L del número total de partículas dispersas del soluto (M) y de la temperatura en kelvin de la solución (T).
π = M R T
Calculo del M
Soluto que no se disocia
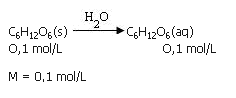
Soluto que se disocia (ácido, base, sal)
La disociación total (100/) del cloruro de sodio (NaCl)
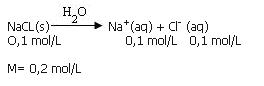
Flujo del Solvente
Observemos la demostración
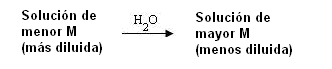
El flujo será de la solución de menor concentración (M) para la solución con concentración mayor.
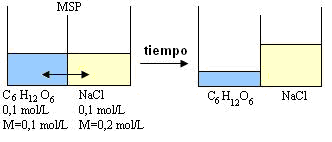
Reparemos que con el pasar del tiempo, la solución de NaCl aumentó, lo que quiere decir que la presión osmótica de esa solución es mayor.
Ósmosis natural: La salida del medio menos concentrado para el medio más concentrado.
Ósmosis inversa: La salida del medio más concentrado para el medio menos concentrado. Siendo:
π = Presión osmótica de la solución
M = Concentración del soluto en solución, expresado en moles/L (molaridad)
R = Constante universal de los gases perfectos cuyos valores son 0,082 atm.L.K-1.mol-1 ó 62,3 mmHg.L.K-1.mol-1 ou 8,31 J/mol.K
T = Temperatura en grados Kelvin
i = Factor de corrección de Van’t Hoff
REFERENCIAS
No hay comentarios:
Publicar un comentario