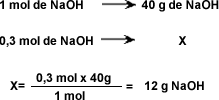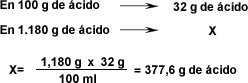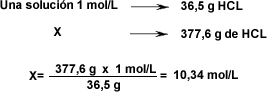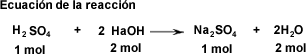“SOLUCIONES”
Una solución es una mezcla homogénea de dos o mas sustancias. La sustancia disuelta se denomina soluto y esta presente generalmente en pequeña cantidad en pequeña cantidad en comparación con la sustancia donde se disuelve denominada solvente. en cualquier discusión de soluciones, el primer requisito consiste en poder especificar sus composiciones, esto es, las cantidades relativas de los diversos componentes.Las soluciones poseen una serie de propiedades que las caracteriza:
| 1. | Su composición química es variable. |
| 2. | Las propiedades químicas de los componentes de una solución no se alteran. |
| 3. | Las propiedades físicas de la solución son diferentes a las del solvente puro : la adición de un soluto a un solvente aumenta su punto de ebullición y disminuye su punto de congelación; la adición de un soluto a un solvente disminuye la presión de vapor de éste. |
Según su estado físico es posible encontrar soluciones en estado liquido, gaseoso y solido, esto va a depender del estado de agregación tanto del disolvente como del soluto.
Estado del soluto | Estado del solvente | Estado de la solución | Ejemplo |
Gas | Gas | Gas | Aire (O2 y N2) |
Gas | Líquido | Líquido | Agua mineral (CO2y H2O) |
Gas | Sólido | Sólido | Hidrógeno de paladio |
Líquido | Sólido | Sólido | Amalgamas (mercurio y oro) |
Sólido | Líquido | Líquido | Sal y agua |
Sólido | Sólido | Sólido | Aleaciones cobre – zinc que forman bronce. |
Según su comportamiento frente a la corriente eléctrica: se clasifican en electrolíticas
que son aquellas que conducen la corriente eléctrica y las soluciones no electrolíticas, las que no conducen.
Electrolíticas
· Son disoluciones de compuestos iónicos o polares en disolventes polares.
· Los solutos se disocian en disolución para formar iones
· Pueden disociarse completamente (electrolitos fuertes)
· Pueden disociarse parcialmente (electrolitos débiles)
· Son disoluciones que conducen la electricidad
EJEMPLOS:
| NaCl | → | Na+ | + | Cl- |
| CaSO4 | → | Ca+2 | + | SO4-2 |
| HCl | → | H+ | + | Cl- |
| AgNO3 | → | Ag+ | + | NO3- |
| NaOH | → | Na+ | + | OH- |
No electrolíticas
· Son disoluciones de compuestos covalentes o en disolventes no polares
· Los solutos no se disocian, solamente se dispersan
· Son disoluciones que no conducen la electricidad
CONCENTRACIONES DE LAS SOLUCIONES La concentración de las soluciones es la cantidad de soluto contenido en una cantidad determinada de solvente o solución. Los términos diluida o concentrada expresan concentraciones relativas. Para expresar con exactitud la concentración de las soluciones se usan sistemas como los siguientes:
a) Porcentaje peso a peso (% P/P): indica el peso de soluto por cada 100 unidades de peso de la solución.
b) Porcentaje volumen a volumen (% V/V): se refiere al volumen de soluto por cada 100 unidades de volumen de la solución.
c) Porcentaje peso a volumen (% P/V): indica el número de gramos de soluto que hay en cada 100 ml de solución.
d) Fracción molar (Xi): se define como la relación entre las moles de un componente y las moles totales presentes en la solución.
Xsto + Xste = 1
e) Molaridad ( M ): Es el número de moles de soluto contenido en un litro de solución. Una solución 3 molar ( 3 M ) es aquella que contiene tres moles de soluto por litro de solución.
REALIZACIÓN DE CÁLCULOS PARA PREPARAR SOLUCIONES
| El cálculo será planteado de la siguiente forma: ¿Cuántos gramos de NaOH se necesitan para preparar 200 ml de solución 0,3 mol/ml?
| |||||||||||||||||||||||||
Una vez obtenido este valor lo que debe hacerse en el laboratorio es pesar 2,4 g de NaOH y disolverlo en aproximadamente 150 ml de agua y luego enrasar el matraz colocando agua hasta que llegue a 200 ml. Y se tendrá una solución de NaOH al 0,3 molar. | |||||||||||||||||||||||||
| Preparación de una solución a partir de líquidos.Por lo general los ácidos deben ser diluidos para utilizarlos (HCl, H2SO4 y HNO3). Estos ácidos se adquieren de manera comercial y traen en la etiqueta del envase la concentración y densidad que permiten calcular su concentración molar para preparar las diluciones. | |||||||||||||||||||||||||
| ¿Cómo preparar una solución a partir de un soluto líquido? 1. Conocer la concentración de la solución madre o solución concentrada a partir de la cual se preparará la solución a la concentración requerida. 2. Establecer la concentración de la solución a preparar y el volumen necesario de la misma. | |||||||||||||||||||||||||
| El cálculo se puede plantear de la siguiente forma: ¿Qué volumen de HCl de 32% en masa y una densidad de 1,18g/ml se necesita para preparar 2 litros de solución a una concentración de 0,5 mol/L (0,5 M)? | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
Para preparar la solución de HCl al 0,5 M, se colocará en un matraz aforado de 2 L la cantidad de 500 ml de agua aproximadamente y se dispensaran lentamente los 96,7 ml de la solución más concentrada, luego se colocará la cantidad de agua necesaria para enrasar hasta el aforo del matraz de 2 L. DETERMINACIÓN DE LA CONCENTRACIÓN DE UNA SOLUCIÓN | |||||||||||||||||||||||||
| Análisis, Valoración volumétrica o titulación: Con estos nombres se define la operación volumétrica mediante la cual se determina la concentración de una solución a partir de otra solución de concentración conocida y con la cual reacciona químicamente. Esta operación volumétrica se fundamenta en la neutralización que experimentan las dos soluciones al reaccionar y que se puede evidenciar al conseguir un cambio de coloración mediante el uso de un indicador apropiado. Existen dos variantes en la valoración volumétrica:acidimetría y alcalimetría. La acidimetría es la valoración de ácidos mediante álcalis (bases) y la alcalimetría es la valoración de álcalis mediante ácidos. | |||||||||||||||||||||||||
El indicador utilizado vira de color cuando el pH de la solución cambia e indica que la cantidad estequiométrica para producir un compuesto conocido al poner en contacto el ácido y la base ha sido alcanzada. Esto permite el cálculo de concentraciones o volúmenes de ácidos o bases a partir de los datos de una solución conocida. El momento en que se produce el cambio de coloración se denomina punto final de la titulación. (ver tabla)
| |||||||||||||||||||||||||
Relación molar 1:1A continuación se muestra un ejemplo de cómo calcular la concentración de una solución ácida cuando la relación molar del ácido y la base es de 1:1. | |||||||||||||||||||||||||
| Para la titulación se utilizaron 42 ml de una solución de NaOH de concentración 0,15 mol/L para neutralizar 50 ml de solución de HCl. ¿Cuál es la concentración molar de la solución ácida? | |||||||||||||||||||||||||
Despejar la fórmula para calcular la concentración del ácido. | |||||||||||||||||||||||||
La concentración de la solución ácida es de 0,126 mol/L | |||||||||||||||||||||||||
Relación molar diferente a 1:1Cuando la relación molar del ácido y de la base es diferente, la ecuación debe ser balanceada antes de iniciar los cálculos. | |||||||||||||||||||||||||
| ¿Cuál es la concentración (mol/L) de una solución de H2SO4, si 50 ml de solución necesitan de 37,52 ml de solución de NaOH cuya concentración es de 0,15 mol/L, para su total neutralización? | ||||||||||||||||||||||||
| Relación molar 1:2 Despejar la fórmula para calcular la concentración del ácido. | |||||||||||||||||||||||||
La concentración de la solución ácida es de 0,0558 mol/L | |||||||||||||||||||||||||
BIBLIOGRAFIA
http://www.eis.uva.es/~qgintro/esteq/tutorial-05.html
http://www.salonhogar.net/quimica/nomenclatura_quimica/Soluciones_preparacion_valoracion.htm
http://www.cespro.com/Materias/MatContenidos/Contquimica/QUIMICA_INORGANICA/soluciones.htm
Krauskopf, K.B. 1979. Introduction to geochemistry. McGraw-Hill, NY, 617 pp